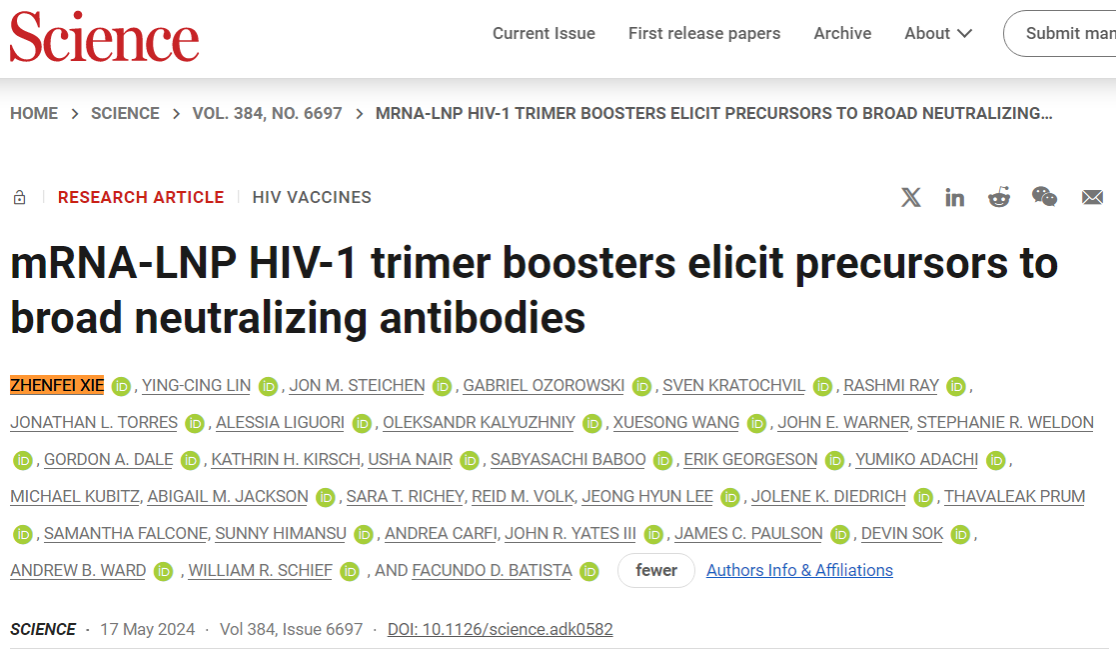
近日,国际顶级期刊《Science》以研究长文的形式在线发表《mRNA-LNP HIV-1 trimer boosters elicit precursors to broad neutralizing antibodies》,报道了人类免疫缺陷病毒(HIV)疫苗研发取得的突破性进展。该研究利用mRNA技术诱导生成针对多种HIV亚型至关重要的广谱性中和抗体(broadly neutralization antibodies,bNAbs)前体,并通过对猕猴的免疫实验,成功诱发了对HIV bnAbs的特异性免疫反应,开辟了开发有效HIV疫苗的新策略。
我院生物科学专业2008级校友谢振飞为该文第一作者。谢振飞于2018年在上海生物化学与细胞生物学研究所取得博士学位后赴美深造,先后于波士顿儿童医院和拉贡研究所从事博士后研究工作,现就职于由麻省总医院、麻省理工学院和哈佛大学共建的拉贡研究所(Ragon Institute of MGH, MIT and Harvard),致力于HIV疫苗研发。
艾滋病(AIDS)是一种由人类免疫缺陷病毒(HIV)引起的危害性极大的传染病。作为一种通过病毒感染导致的传染病,开发出高效预防疫苗,是防控艾滋病的最重要武器。然而,此前的艾滋病疫苗研发几乎都未获成功。谢振飞表示,HIV疫苗的开发是一个长期而又异常艰巨的任务,目前研究所取得的成果离最终成型的HIV疫苗还有相当大的差距。论文上线后,新加坡国立大学的胡纯一教授第一时间对该研究进行了剖析(https://mp.weixin.qq.com/s/ZuEJCd0NlGi-wsQrkM1WxA),他认为,mRNA疫苗技术在HIV预防中的应用开辟了新天地,这一新开发的广谱艾滋病疫苗,有望带领人类在长达几十年的艾滋病预防和治疗的探索中终结这一疾病。
bNAbs是一类能特异性识别病毒,并阻断病毒复制、扩增或传播的抗体,也是疫苗发挥功效的主要效应物。该项研究基于种系细胞靶向激活(germline targeting,GT)和递进式免疫(sequential immunization)的理念,综合大规模体外筛选开发了GT免疫原和加强免疫原(booster),并使用“人源化”小鼠B细胞评估其有效性。研究人员首先证明了GT免疫原N332-GT5能够特异性激活bNAb前体细胞,并在强烈活化的情况下驻留GC(germinal center)长达49天。并且,进化了42天的前体细胞对抗原的亲和力提高了几十倍,证实了使用人源化小鼠模型进行HIV疫苗研究的有效性。接下来研究人员设计了加强免疫原B11和B16,并探究它们能否将激活的前体细胞进一步诱导成熟。相较于只进行N332-GT5初次免疫的小鼠,进行加强免疫后,更多前体细胞被持续活化,突变率持续增长,亲和力也随之增加,证明了加强免疫原的有效性。
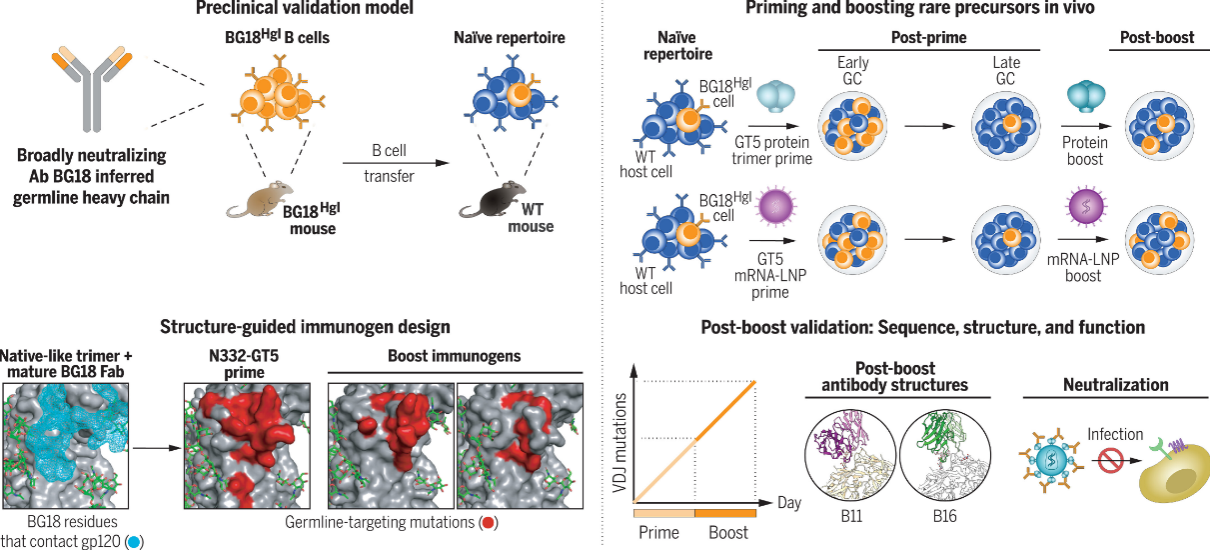
在此基础上,研究人员进一步使用了与以上蛋白质免疫原对应的mRNA-LNP疫苗进行实验,发现初次免疫的GT5 mRNA免疫原能够有效复刻其蛋白的免疫原性。随后,制备成mRNA-LNP形式的booster在增加突变率、提高亲和力方面比蛋白booster更高。最后研究人员进行了体外假病毒中和能力检测,发现这些BG18前体细胞已经能有效中和一些中间型类原始病毒,但并不能中和完全原始型毒株,提示尚需更多的中间型boosters进一步诱导直至完全成熟。
艺术家为本文设计了一幅龙凤戏珠的插画,龙代表mRNA-LNP免疫原,凤代表蛋白质免疫原,珍珠代表bNAb前体细胞。龙和凤迸射出的火焰使前体细胞(珍珠)进化成熟,mRNA-LNP的迭代免疫途径(龙)比蛋白免疫(凤)效果更好。

插画由Christina Corbaci和Lars Hangartner设计
原文链接:https://www.science.org/doi/10.1126/science.adk0582