近日,学院杜小刚教授领衔的“鱼类免疫调控与环境健康”团队在鱼类先天免疫调控机制研究方面取得重要进展,系统揭示了鱼类特有的Toll样受体25(TLR25)分子通过MyD88依赖性信号通路提高IRF1蛋白稳定性,进而促进IFNa基因表达的分子机制。相关研究以“Teleost-specific TLR25/MyD88 signaling promotes K63-linked ubiquitination of IRF1 to induceIFNagene expression”为题,发表于水生动物免疫学领域权威期刊《Fish and Shellfish Immunology》。

干扰素(IFNs)是鱼类抵御病原入侵的关键细胞因子,其中IFNa具有广谱抗病毒和抗菌功能。干扰素调节因子1(IRF1)是调控IFNa基因表达的关键转录因子,但其蛋白稳定性差、易被泛素化降解,限制了其免疫功能的发挥。目前,鱼类中IRF1蛋白稳定性的上游调控机制尚不明确。
本研究以雅鱼(Schizothorax prenanti)为对象,首次发现鱼类特有的TLR25可通过其TIR结构域直接招募下游接头蛋白MyD88,激活下游NF-κB炎症通路,并显著增强IRF1的蛋白稳定性。进一步机制解析表明,TLR25/MyD88信号通路优先促进IRF1的K63泛素化修饰,竞争性限制其K48泛素化降解,从而增强IRF1的蛋白稳定性和转录活性,诱导IFNa基因高效表达。该过程中的这种增强作用依赖于TLR25/MyD88驱动的NF-κB炎症通路激活。
该研究不仅首次在鱼类中揭示了“TLR25-MyD88-IRF1-IFNa”这条新型免疫信号轴,还初步阐明了IRF1蛋白稳定性调控的泛素化修饰机制,填补了鱼类IRF1翻译后调控研究的空白。研究成果为理解鱼类免疫系统的演化与调控提供了新视角,也为鱼类病害防控和抗病育种提供了潜在的分子靶点和理论依据。
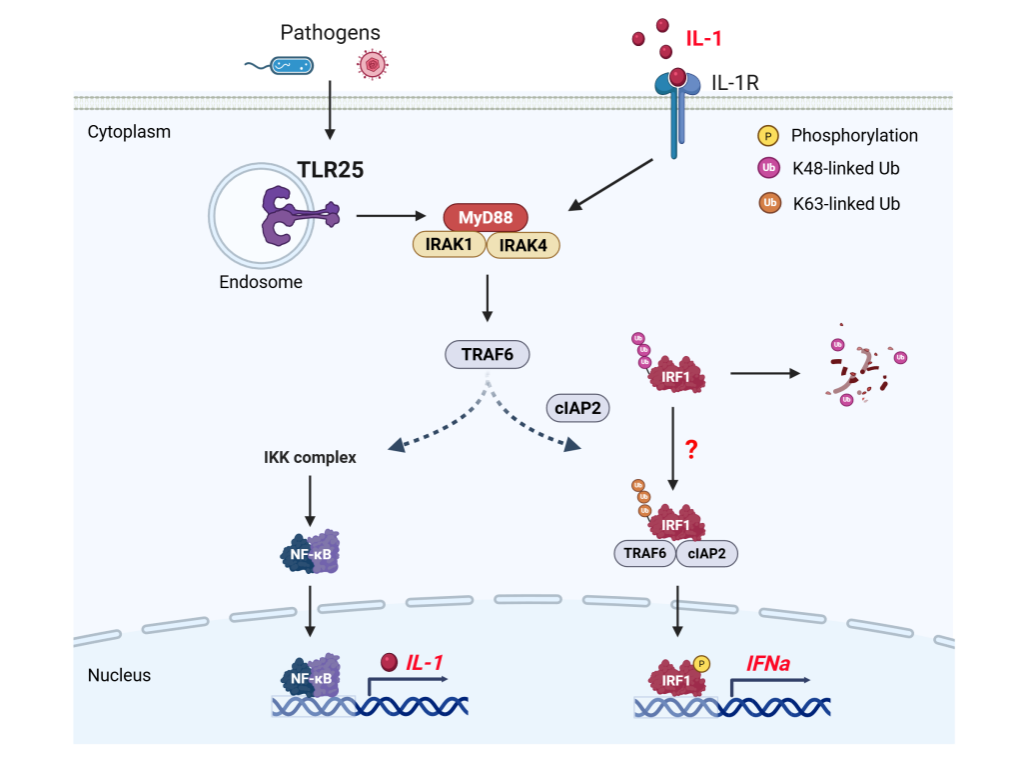
鱼类特有TLR25/MyD88信号通路调控IRF1诱导IFNa基因表达的机制图
李云坤副教授为该文第一作者兼通讯作者,已毕业硕士研究生易仕惠为共同第一作者,硕士研究生唐吴昊、石雷和鄢慧珍参与了重要工作,曾宪垠教授和杜小刚教授为共同通讯作者,四川农业大学生命科学学院为第一完成单位。该研究得到了中国博士后科学基金(2024M752297)、四川省科技计划项目(2021YFYZ0015)和现代农业产业技术体系四川创新团队项目(SCCXTD-2024-15)的资助。
原文链接:Doi: 10.1016/j.fsi.2025.110672